











































































































































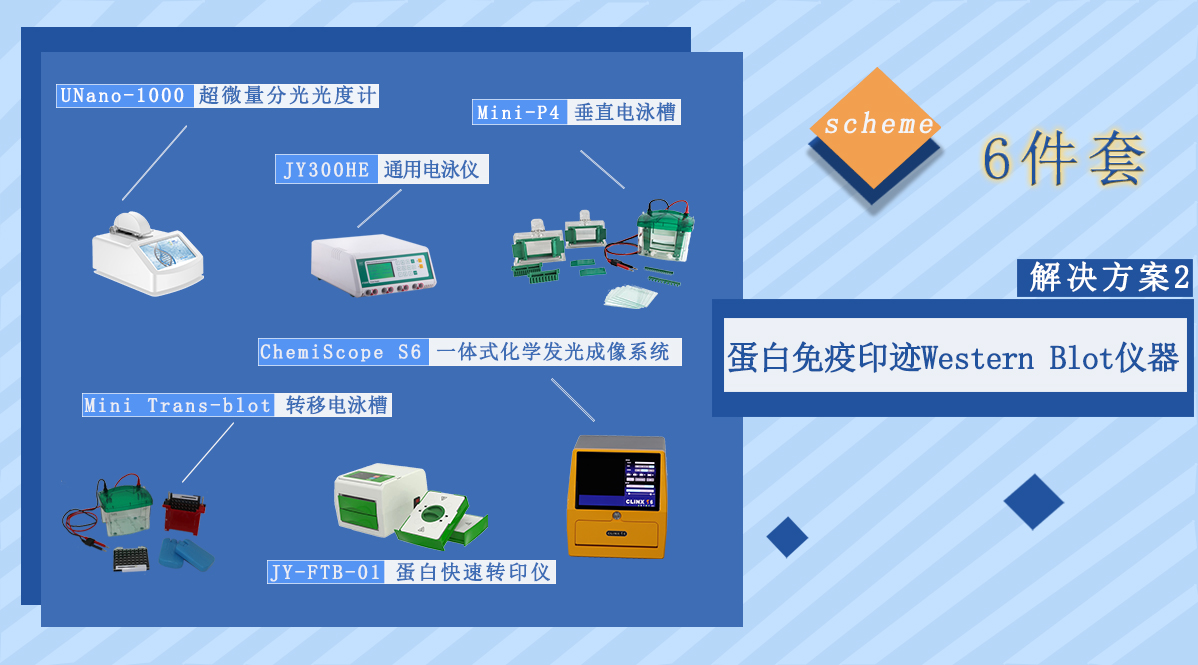

为实验室提供优越、稳定、成熟的蛋白(Western Blot)实验配套仪器。

蛋白研究广泛应用于生命科学相关各种研究方向,特别是功能性研究绝大部分以蛋白研究为主,对蛋白进行研究的方法中Western Blot(蛋白免疫印迹,WB)是最基础、最常用的实验方法,每篇蛋白相关的研究结果其中几乎都有WB结果数据。如何做好WB不仅需要高质量的抗体等试剂,还需要一系列成套实验设备:在样品提取后需要对所提取样品进行质控和定量,以便上样量准确可控,便于对实验结果评价和归一化分析,蛋白定量常用分光光度计,考虑到蛋白分子相关实验样品量都比较小,常规定量又会浪费掉大量样品,所以超微量分光光度计仅需0.5~2μL样品就可以实现样品的精准定量,给后续实验保留足够的样品量,也可以用垂直电泳槽跑一次电泳,进行考马斯亮蓝或者银染,能够更直观看到样品提取质量和定量的准确性。由于蛋白性质、蛋白分子量、抗体性质等存在极大差别,电泳、转膜需要可靠的蛋白电泳槽、转印槽和配套电泳仪等,以便对电泳上样量、电泳参数、转膜参数等进行优化,如果想进一步提高电泳、转膜效率,可以使用快转胶配合使用快速转印仪,能够实现15分钟跑胶3分钟转印。快速转印仪无需外接电泳仪,并可以同时运行两个独立的转印槽,避免了实验过程中有并行实验产生时间冲突。WB实验结果采集方法使用化学发光成像仪,采用制冷级高灵敏度CCD相机可以一键曝光出合适的结果图片。成像结果可以直接进行定性、半定量分析,从而达到对科研对象中对应的蛋白功能进行研究的目的。


■ 蛋白测定Unano-1000超微量分光光度计:自动检测,无需外接电脑,内置打印机
■ 蛋白电泳JY300HE通用型电泳仪:数字按键,易于使用
■ 蛋白电泳Mini-P4垂直电泳槽:经典的跑转一体槽,可容纳 1-4 块手灌胶或Ready Gel 预制胶
■ 蛋白转膜Mini Trans-blot转移电泳槽:与Mini-P4垂直电泳槽配套使用
■ 蛋白转膜JY-FTB-01蛋白快速转印仪:十分钟轻松完成四块凝胶的快速印迹转移
■ 成像分析保存ChemiScope S6一体式化学发光成像系统:一键式曝光,灵活的模块化设计,满足化学发光实验需求

蛋白测定Unano-1000超微量分光光度计 • 仅需要0.5-2ul样品 • 波长范围:190-850nm • 核酸检测:2-15000 • DNA和RNA(260nm) • 纯化蛋白质(280nm) • 计算样品纯度比值(A260/A280nm及A260/A230nm) • 光密度测量(600nm)OD600光路检测系统 • 自动快速检测核酸、蛋白质、细胞溶液 • 7寸高清电容触摸屏无需电脑连接 • 内置打印机,结果可以直接导出方便用户数据管理 |  |
蛋白电泳JY300HE通用型电泳仪 • 具有自动记忆、自动关断功能 • 具有分步控制功能(可编辑10组,每组最多使10个程序自动连接运行) • 输出类型:恒压、恒流、恒功率输出(连续可调) • 输出范围:5~300V、1~1500mA、1~450W • 分 辨 率:电压(1V)、电流(1mA)、功率(1W) • 定时范围:1分钟~99小时59分钟 • 伏时范围:1~99999V-hr/增量1V-hr • 显 示:带背光的LCD液晶屏 • 输出插孔:4组 • 外形尺寸(L×W×H):280×237×118(mm) |  |
蛋白电泳Mini-P4垂直电泳槽 • 长玻璃板面积(W×L):101×82(mm) • 短玻璃板面积(W×L):101×73(mm) • 凝胶面积(W×L):83×73(mm) • 凝胶厚度:1.0mm(标配);0.75mm,1.5mm(选配) • 凝胶数量:1~4(块) • 样品通量: 10、15齿; • 缓冲液体积:2块胶:700ml;4块胶:1000ml • 外形尺寸(L×W×H): 170×130×150(mm) • 净重:1.0(kg) |  |
蛋白转膜Mini Trans-blot转移电泳槽 • 转移面积(W×L):100×75(mm) • 缓冲液容积:~700ml • 外形尺寸(L×W×H):170×130×150(mm) • 净重:0.8(kg) |
|
蛋白转膜JY-FTB-01蛋白快速转印仪 • 支持快速半干转,可在5-25分钟完成快速、高效的10-250KDa蛋白转印 • 单次运行可转印1-4块小型凝胶或1-2块中型凝胶 • 搭载智能化触摸屏,含一键预设快转功能 • 可兼容传统的半干转耗材,每块凝胶转印最低只需100ml缓冲液 • 中英文双语界面,一键切换,国际通用 |  |
成像分析保存ChemiScope S6 一体式化学发光成像系统 • 操作便捷:一键点击,获得满意实验效果 • 高灵敏度:高灵敏度制冷CCD相机和大光圈镜头搭配,捕捉低丰度条带的微弱发光信号 • 智能操作:放上样品,一键点击,进仓自动拍摄白光marker和化学发光图像,并自动进行叠加 • 小巧机身:整机尺寸只有286mm * 355mm *321mm,内置10.1英寸触屏操控,节省实验室空间 • 数据传输:USB接口 应用范围 基于ECL、ECL PLUS等的化学发光样品的检测,比如Western Blot,Northern Blot,Southern Blot等实验相关的印迹膜等。 |  |

1.图像采集软件功能
1.1具有自动曝光、手动曝光及多帧拍摄模式
1.2拍摄完成的所有图像在软件拍摄界面以小窗口全部显示,方便进行后续处理、查找、浏览
1.3软件具有自动拍摄Marker图像及将marker图像与化学发光图像自动叠加功能;
1.4采用先进的像素合并技术,提高灵敏度和信噪比;
*1.5一次拍摄无需任何操作即可自动呈现化学发光图、marker图、叠加图;
*1.6拍摄完成后自动生成专业CLX文件格式,富含原始数据信息(如:marker图、化学发光图、叠加图、曝光时间、拍摄日期等)
2.图像分析软件功能
2.1具有支持16bit图像的旋转,裁切,等处理功能,确定最适的图像视野。
2.2自动识别泳道条带,并且可以根据需要添加、删除,调整泳道,实现泳道的精确分离。
2.3自动计算泳道中各条带的光密度强度
2.4 彩色图像合成:应能显示不同调色板图像;应能根据荧光发射光谱将多个通道荧光图像合成为彩色图像;应能进行序列图像的合成。
2.5分析结果可根据选择范围输出至Excel文件。

1. A small and highly sensitive red/far-red optogenetic switch for applications in mammals. Nature Biotechnology (2021) 54.09
2. Yang, Jingyun, et al. "A vaccine targeting the RBD of the S protein of SARS-CoV-2 induces protective immunity." Nature (2020): 1-9. 41.577
3. Tian J, Wang C, Xia J, et al. Teosinte ligule allele narrows plant architecture and enhances high-density maize yields[J]. Science, 2019, 365(6454): 658-664. 41.03
4. Yang H, Hu M, Guo J, et al. Pore architecture of TRIC channels and insights into their gating mechanism[J]. Nature, 2016, 538(7626): 537. 41.577
5. Zhuo W, Liu Y, Li S, et al. Long Noncoding RNA GMAN, Up-regulated in Gastric Cancer Tissues, Is Associated With Metastasis in Patients and Promotes Translation of Ephrin A1 by Competitively Binding GMAN-AS[J]. Gastroenterology, 2019, 156(3): 676-691. e11 20.77
6. Liu Z, Wang L, Xu H, et al. Heterogeneous Responses to Mechanical Force of Prostate Cancer Cells Inducing Different Metastasis Patterns[J]. Advanced Science, 2020, 7(15): 1903583. 15.83
7. Wang J, Yu C, Zhang S, et al. Cell-type-dependent histone demethylase specificity promotes meiotic chromosome condensation in Arabidopsis[J]. Nature plants, 2020, 6(7): 823-837. 13.25
8. Tie, Yan, et al. "Targeting folate receptor β positive tumor-associated macrophages in lung cancer with a folate-modified liposomal complex." Signal transduction and targeted therapy 5.1 (2020): 1-15 13.49
9. Yu Y , Wu X , Guan N , et al. Engineering a far-red light–activated split-Cas9 system for remote-controlled genome editing of internal organs and tumors[J]. Science Advances, 2020, 6(28):eabb1777. 13.117
10. Du K , Luo Q , Yin L , et al. OsChz1 acts as a histone chaperone in modulating chromatin organization and genome function in rice[J]. Nature Communications, 2020, 11(1). 12.353
11. Wu S, Zhong G, Zhang J, et al. A single dose of an adenovirus-vectored vaccine provides protection against SARS-CoV-2 challenge[J]. Nature communications, 2020, 11(1): 1-7. 12.353
12. Stietz M S, Liang X, Li H, et al. TssA–TssM–TagA interaction modulates type VI secretion system sheath-tube assembly in Vibrio cholerae[J]. Nature Communications, 2020, 11(1): 1-11. 12.353
13. Wu J , Wang M , Yang X , et al. A non-invasive far-red light-induced split-Cre recombinase system for controllable genome engineering in mice[J]. Nature Communications, 2020, 11(1). 12.353
14. Zui Zhang1,2, Juan Guan1 , Zhuxuan Jiang1 , et al Brain-targeted Drug Delivery by Manipulating Protein Corona Functions Nature communications,2019 12.353
15. Luo Y, Teng X, Zhang L, et al. CD146-HIF-1α hypoxic reprogramming drives vascular remodeling and pulmonary arterial hypertension[J]. Nature communications, 2019, 10(1): 1-17. 12.353
16. Duan J L, Ruan B, Yan X C, et al. Endothelial Notch activation reshapes the angiocrine of sinusoidal endothelia to aggravate liver fibrosis and blunt regeneration in mice[J]. Hepatology, 2018, 68(2): 677-690.
17. Bian, R., Andika, I. B., Pang, T., Lian, Z., Wei, S., Niu, E., ... & Sun, L. (2020). Facilitative and synergistic interactions between fungal and plant viruses. Proceedings of the National Academy of Sciences, 117(7), 3779-3788. 9.5
18. Shao J, Wang M, Yu G, et al. Synthetic far-red light-mediated CRISPR-dCas9 device for inducing functional neuronal differentiation[J]. Proceedings of the National Academy of Sciences, 2018, 115(29): E6722-E6730. 9.5

| 清华大学化学系 | 中国疾病预防控制中心病毒病所 |
| 北京师范大学细胞生物学研究所 | 中国科学院生物物理研究所 |
| 北京大学医学部组织与免疫系 | 中国科学院生物物理研究所 |
| 北京大学医学部 | 中国科学院生物物理研究所 |
| 北京大学医学部 | 中国科学院生物物理研究所 |
| 中国农业大学农学院 | 中国科学院生物物理研究所 |
| 中国农业大学农学院 | 中国科学院微生物研究所 |
| 中国农业大学农学院 | 中国科学院微生物研究所 |
| 中国农业大学种子科学中心 | 中国农业科学院作物科学研究所 |
| 中国农业大学动物医学院 | 中国农业科学院作物科学研究所 |
| 中国农业大学农业部饲料工业中心 | 中国农业科学院作物科学研究所 |
| 中国农业科学院农产品加工研究所 | 中国农业科学院作物科学研究所 |
| 中国农业科学院农产品加工研究所 | 北京农林科学院 |
| 中国农业科学院农产品加工研究所 | 复旦大学医学院分子医学教育部重点实验室 |
| 军事医学科学院微生物流行病研究所 | 复旦大学生命科学学院李瑶组 |
| 北京中医药大学 | 复旦大学生科院院马红组 |
| 北京中医药大学 | 复旦大学生科院余巍组 |
| 中国中医研究院中药研究所 | 复旦大学生科院逸夫科技楼 302 室 |
| 中国中医科学院中药研究所 | 复旦大学生科院遗传楼 5015 室 |
| 中国中医科学院 | 复旦大学生科院遗传楼 304 室 |
| 中国医学科学院药物研究所 | 复旦大学生科院杨青课题组 |
| 中国药科大学药学院药理教研室 | 复旦大学生科院生物化学系 |
| 中国药科大学临床药理实验室 | 复旦大学生科院生物二楼 204 室 |
| 中国热带农业科学院香蕉所 | 复旦大学生科院黄青山课题组 |
| 中国热带农业科学院品资所 | 复旦大学生科院蔡亮课题组 |
| 中国农科院生物技术所 | 复旦大学附属肿瘤医院实验中心 |
| 中国科学技术大学生科院 | 中科院遗传与发育所 |
| 中国科学技术大学脑功能重点实验室 | 中科院上海植生所 |
| 中国科技大学生科院刘强课题组 | 中科院上海药物所楼丽广课题组 |
| 中科院生物物理研究所秦燕课题组 | 中科院广州健康研究院 |
| 中科院生物物理研究所柳振峰课题组 | 中科院植物研究所 |
| 中科院生物物理研究所 (东京大学合作实验室) | 中科院生物物理研究所阎锡蕴课题组 |
| 中科院生物物理研究所秦志海课题组 | 中科院生物物理研究所王志珍课题组 |

